Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 :
Structure de la matière
Les solides moléculaires
Les solides moléculaires
1. Définition
Un solide moléculaire est un solide constitué uniquement de molécules.
Une molécule est un ensemble neutre qui ne porte pas de charge électrique.
Puisqu'une molécule est électriquement neutre, une force électrostatique ne
peut s'exercer directement entre deux molécules, c'est donc un autre type
d'interaction qui assure la cohérence de ce type de solide.
2. L'électronégativité
Par définition une liaison covalente correspond à la mise en commun
de deux électrons par deux atomes.
Cependant il arrive que ce partage d'électrons ne se fasse pas à «parts
égales» et que l'un des atomes exerce une attraction plus forte que l'autre:
les électrons sont alors «décalés» vers celui-ci et on dit que cet
atome est plus électronégatif.
L'électronégativité caractérise donc la tendance d'un
atome à attirer vers lui les électrons qui font parte d'une liaison
covalente.
3. L'électronégativité des différents éléments
et la classification périodique
L'électronégativité est une caractéristique
qui varie régulièrement dans la classification périodique:
Sur une période l'électronégativité augmente de gauche à droite.
Ainsi, par exemple, le fluor est plus électronégatif que l'oxygène qui
est lui-même plus électronégatif que l'azote etc.
Dans une colone l'électronégativité augmente du bas vers le haut.
Ainsi, par exemple, l'oxygène est plus électronégatif que le soufre qui
est lui même plus électronégatif que le sélenium.
4. Les liaisons polarisées
Une liaison covalente est dite polarisée si les deux atomes qui sont liés ont des électronégativités très différentes.
Dans ce cas le décalage des électrons conduit à noter
une charge partielle négative δ- sur l'atome le plus électronégatif et une charge
partielle positive δ+ sur le moins électronégatif.
Voici des exemples de liaisons polarisées:
δ-O-Hδ+ ,
δ+C-Oδ- ,
δ+C-Clδ-,
δ+H-Clδ-
Pour certains atomes la différence d'électronégativité est si faible qu'on peut
considérer que la liaison n'est pas polarisée. C'est en particulier le cas pour
la liaison entre un atome de carbone et un atome d'hydrogène que l'on retrouve
dans les molécules organiques.
5. L'interaction de Van der Waals
Dans les solides moléculaires il existe une interaction qui s'exerce entre les
molécules appelée interaction de Van der Waals.
Cette intéraction est d'autant plus importante que les liaisons sont
polarisées. Cependant, elle peut s'exercer aussi entre des atomes initialement
non polarisés mais dont l'environnement, c'est à dire les atomes voisins, provoque
une polarisation temporaire.
L'interaction de Van der Wall est donc une interaction électrostatique entre
les charges partielles de liaisons d'atomes polarisés de manière permanente ou
temporaire. Elle assure la cohérence des solides moléculaires.
 Voir les forces de van der Waals
Voir les forces de van der Waals
6. La liaison hydrogène
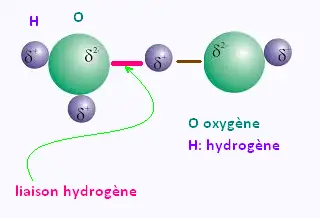 La liaison hydrogène est une interaction qui peut se produire
lorsqu'un atome d'hydrogène est lié à un atome très électronégatif,
comme l'oxygène.
La liaison hydrogène est une interaction qui peut se produire
lorsqu'un atome d'hydrogène est lié à un atome très électronégatif,
comme l'oxygène.
L'hydrogène interagit alors avec les doublets non liants d'atomes
électronégatifs comme l'oxygène, le chlore ou l'azote.
Cette interaction est nettement plus intense que celle de Van der Waals.
|
|