Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie 23 : Physique atomique
Raies spectrales du Sodium
Spectre d'émission de l'atome de sodium
Spectre d'absorption de l'atome de sodium
Interprétation microscopique des
échanges d'énergie
Le sodium Na est un métal mou et argenté. IL appartient aux métaux alcalins.
Son numero atomique est Z = 11 , sa masse atomique est
A = 23 . Il n'est pas à l'état
de corps pur dans la nature, mais il est très abondant sous forme de composés,
comme dans le sel de cuisine. Il brûle dans l'air avec une flamme jaune.
Spectre d'émission de l'atome de sodium.
1. Lampes à vapeur de sodium
On utilise les lampes à vapeur de sodium pour éclairer des autorotes ou
des tunnels routiers. Ces lampes contiennent de la vapeur de sodium à très faible
pression.
Cette vapeur est excitée par un faisceau d'électrons qui traverse le tube.
Par collision, ces électrons projctiles perdent leur énergies. Celles-ci sont
tranférées aux électrons de l'atome cible.
Les atomes de sodium cible absorbent l'énergie des électrons. L'énergie est restituée
lors du retour des électrons à l’état fondamental sous forme de radiations
lumineuses.
Les lampes à vapeur de sodium émettent surtout de la lumière jaune.
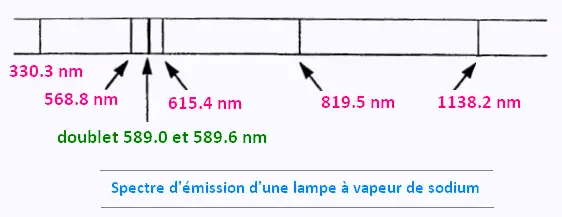
L'analyse du spectre d'émission d'une lampe à vapeur de sodium
révèle la présence de raies de longueur d’onde bien définie.
2. Calculs relatifs au
spectre des raies du Sodium
a) Quelles sont les longueurs d’onde des raies appartenant au domaine du visible ? Au domaine
des ultraviolets ? Au domaine de l'infrarouge ?
b) S’agit-il d’une lumière polychromatique ou monochromatique ?
c) Quelle est la valeur de la fréquence ν de la raie de longueur d'onde λ = 589.0 nm ?
d) Parmi les données présentées en début de l'exercice, que représentent les grandeurs h et e ?
2. Le diagramme simplifié des niveaux d’énergie de l'atome de sodium est donné .
a) Indiquer sur ce diagramme l’état fondamental et les états excités.
b) En quoi ce diagramme permet-il de justifier la discontinuité du spectre d’émission d'une lampe
à vapeur de sodium ?
3. On considère la raie jaune du doublet du sodium de longueur d’onde λ = 589.0 nm.
a) Calculer l'énergie ΔE (en eV) qui correspond à l'émission de cette radiation (on donnera le
résultat avec le nombre de chiffres significatifs adapté aux données).
b) Sur le diagramme, indiquer par une flèche notée 1 la transition correspondante (ne pas
justifier).
4. L’atome de sodium, considéré maintenant à l'état E1, reçoit une radiation
lumineuse dont le quantum d’énergie ΔE’ a pour valeur 1.09 eV.
a) Cette radiation lumineuse peut-elle interagir avec l’atome de sodium à l'état E1 ?
b) Représenter sur le diagramme la transition correspondante par une flèche notée 2.
c) La raie associée à cette transition est-elle une raie d’émission ou une raie d'absorption ?
Données :
h = 6.62 x 10- 34 J.s
c = 3.00 x 108 m.s- 1
e = 1.60 x 10- 19 C
1 eV = 1.6 x 10- 19 J
h est la constante de Planck, c est la vitesse de la lumière dans
le vide et e est la charge électrique élémentaire.
eV signifie electron-Volt, l'unité utilisée en énergie atomique, puisque
le Joule est une unité très grande.
1.
a) Les radiations émises par le sodium ne sont pas toutes visibles.
Seules sont visibles celles dont les longueurs d'onde des raies appartenant
au domaine du visible c'est à dire du 568.8 nm , 589.0/589.6 nm , et 615.4 nm.
Les raies invisibles sont celles du domaine des ultraviolets 330.3 nm; et du
domaine de l'infrarouge : 819.5 nm et 1138.2 nm.
b) Le spectre d'émission du Sodium montre qu'il s'agit d'une lumière polychromatique
car elle est constituée de plusieurs radiations de longueurs d’onde différentes.
c) Pour passer de la fréquence ν à la longueur d'onde λ ou l'inverse,
on utilise la formule suivante:
ν = c/λ
ν s'exprime en Hz et λ s'exprime en nm.
Exemple : Quelle est la valeur de la fréquence ν de la raie de longueur
d'onde λ = 589.0 nm ?
ν = c/λ = 3.00 x 108 (m/s)/ 589.0 x 10- 9 (m) =
5.09 x 1014 Hz
ν = 5.09 x 1014 Hz

2. a) Le diagramme des niveaux d’énergie de l’atome de sodium montre
l'état fondamental, les états excités, et le continium (état ionisé).
b)
Les niveaux d'énergie de l'atome sont
quantifiés: ils ne peuvent prendre que des valeurs bien
précises.
L'énergie de l'atome étant quantifiée, ses spectres d'émission ou d'absorption seront
discontinus .
3. a) On considère la raie jaune du doublet du sodium de longueur d’onde λ = 589.0 nm .
On veut calculer l'énergie ΔE (en eV) qui correspond à l'émission de cette radiation:
ΔE = h.ν
ΔE = h.ν => ΔE = h. c/λ =
6.62 x 10- 34 x 3 x 108/589.0 x 10- 9 =
3.37 x 10- 9 ou 2.11 eV
ΔE = 2.11 eV
b)
On a : ΔE = E1 – E0 = - 3,03 + 5,14 = 2,11 eV. Il s’agit donc de la transition entre E1
et E0 : de E0 à E1 ( vers le haut)
4.
L'atome de sodium, considéré maintenant à l'état E1, reçoit une radiation
lumineuse dont le quantum d'énergie ΔE' a pour valeur 1.09 eV.
On veut savoir si cette radiation lumineuse peut interagir avec l'atome de sodium à l'état
E1.
Pour que cette radiation interagisse avec cet atome, il faut qu'il existe dans l'atome
un niveau d'énergie En tel que En = E1 + ΔE’. C'est à dire qu'il possède un niveau
d'énergie énergie ΔE’ telle que : ΔE’ = - 3,03 + 1,09 = - 1,94 eV.
Ce niveau ΔE’ = - 1,94 eV existe et il s’agit donc de la transition
entre E1 et E2 : vers le haut.
b) La raie associée à cette transition une raie d'absorption puisque l'énergie
de l'atome augmente.
|
|