Chimie23 : Les solutions aqueuses
La dissolution
La dissociation
La solvatation
La dispersion
Un solide ionique se dissocie, se solvate et se disperse
dans son solvant pour former une nouvelle solution.
La dissolution
1. La dissociation
Lorsqu'un solide ionique est mis en contact avec un solvant polaire comme l'eau, le premier phénomène qui se produit est la dissociation.
Pendant une dissociation moléculaire, les intéractions relatives à la polarité du solvant sont plus fortes que les forces électrostatiques qui maintiennent initialement les cations et les anions ensemble dans le solide ionique . Ces derniers se séparent petit à petit; le solide
se dissocie.
2. La solvatation
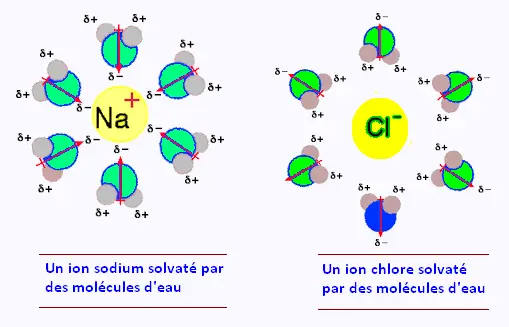
Un phénomène de dissolution est le phénomène de solvatation
des sels:
les molecules d'eau entourent les ions et interagissent avec eux.
Les charges partielles positives de l'eau s'orientent vers les anions
tandis que les charges partielles négatives s'orientent vers les cations.
3. La dispersion
Le dernier phénomène est la dispersion. Sous l'effet de
l'agitation inhérente aux molécules d'eau liquide, les ions et les molécules
qui les solvatent se dispersent dans le liquide.
4. L'équation de dissolution
La dissolution d'un solide ionique peut être représentée par une
équation de réaction dans laquelle figure le solide de départ et les ions formés.
La gauche de l'équation comporte la formule du solide suivi entre parenthèses
du signe (s) qui indique le composé est encore sous forme de solide cohérent.
La droite de l'équation comporte les formules des ions formés accompagnées
si nécessaire des coefficients stoechiométriques qui découlent directement
de la formule du solide ionique initial.
La formule des ions est suivie entre parenthèse de (aq) qui signifie aqueux
indiquant que ces ions sont dissouts dans une solution aqueuse.
Exemple:
Dissolution du Chlorure de cuivre CuCl2:
CuCl2(s) → Cu(aq) + 2Cl-(aq)
5. La concentration molaire
• Notation d'une concentration
Chaque sorte d'ion dissous possède une concentration donnée que l'on
note en mettant entre crochets la formule de l'ion.
Par exemple la centration en ions cuivre est notée [Cu2+] et celle
en ions chlorure est notée [Cl-].
• Relation entre les concentrations
Lorsqu'on dissous un solide ionique les proportions entre les
concentrations de cations et d'anions est la même que celle qui existe
initialement dans le solide ionique.
Par exemple, dans le Clorure de cuivre la formule CuCl2 indique qu'il y
a deux fois plus d'ions chlorure que d'ions cuivre ce qui implique que la
concentration d'ions chlorure [Cu2+] est aussi deux fois plus grande que
la concentration d'ions cuivre [Cl-] :
[Cl-] = 2 x [Cu2+].
|