Maths 436
Sciences
Révisions
Mathématiques
Corrigés
Sciences
© The scientific sentence. 2010
|
Chimie:
Les propriétés des solutions
Je confirme mes acquis
Les propriétés des solutions
1. Les ions
1.
a. Qu’est-ce qu’un ion ?
Un ion est un atome
qui porte une charge électrique positive ou
négative.
b. Comment se forme un ion négatif ?
Un atome gagne un ou plusieurs électrons.
c). Donnez les synonymes d’ion positif et
d’ion négatif.
Ion positif : cation.
Ion négatif : anion.
2. Quel ion les atomes suivants auront-ils tendance
à former ?
a. N
N3–
b. I
I–
c. Ca
Ca2+
d. K
K+
e. S
S2–
3. Quel est le nom du processus au cours duquel
un atome se transforme en ion ?
L’ionisation.
4.
a. Qu’est-ce qu’un ion polyatomique ?
Un ion polyatomique est un groupe
d’atomes fortement liés entre eux et qui
portent une charge électrique causée par
un surplus ou un déficit d’électrons.
b. Nommez les ions polyatomiques
suivants:
1. PO43–
Phosphate
2. NO3
– Nitrate
3). OH–
Hydroxyde
4. NH4
+ Ammonium
5) CO32–
Carbonate
2. La dissolution et la solubilité
1. En quoi consiste la dissolution ?
La dissolution est l’action de mélanger un ou
plusieurs solutés avec un solvant afin d’obtenir
une solution.
2. Qu’est-ce qu’une solution aqueuse ?
Une solution aqueuse est une solution liquide
dont le solvant est l’eau.
3. Qu’est-ce qu’une solution liquide ?
Une solution liquide est une solution dont le
solvant est un liquide.
4. Expliquez sommairement le processus de
la dissolution moléculaire.
Au cours de la
dissolution moléculaire, les molécules de soluté
sont, les unes après les autres, attirées puis
entourées par des molécules de solvant, avant
d’être détachées des autres molécules de
soluté. Les molécules de soluté demeurent
intactes et se dispersent uniformément entre
les molécules de solvant.
5. Expliquez sommairement le processus de
la dissolution ionique.
Au cours de la dissolution
ionique, le soluté est fragmenté en ions qui
se répartissent uniformément entre les
molécules de solvant.
6. Si on dissout 50 g de sucre dans 1 000 g
d’eau, quelle sera la masse finale
de la solution obtenue ?
1 050 g
7. Si on dissout 80 mL d’alcool dans 200 mL
d’eau, quel volume de solution pourrait-on
obtenir ?
Un volume inférieur à 280 mL.
8. Pourquoi l’huile est-elle insoluble dans
l’eau ?
Les molécules d’eau s’attirent entre
elles plus fortement qu’elles n’attirent les
molécules d’huile. Les molécules d’huile restent
donc ensemble et il ne se forme pas de solution.
9. Qu’est-ce qu’une solution saturée ?
Une
solution saturée est une solution dans laquelle
la quantité de soluté déjà dissous est telle
qu’on ne peut plus y dissoudre de soluté
supplémentaire: toute quantité supplémentaire
formera un dépôt.
10. Qu’est-ce que la solubilité ?
La solubilité
désigne la quantité maximale de soluté pouvant
être dissoute dans un volume donné de solvant
à une température donnée.
11. Si on peut dissoudre un maximum de 5 g de
soluté en poudre dans 25 mL d’eau à 25 °C,
quelle est la solubilité de cette substance
exprimée en g/100 mL ?
20 g/100 mL
12. Étant donné que les substances solides
sont généralement plus solubles dans un
solvant chaud, qu’observerait-on dans la
solution préparée en b) si on la faisait
refroidir ?
Un dépôt de soluté solide se
formerait.
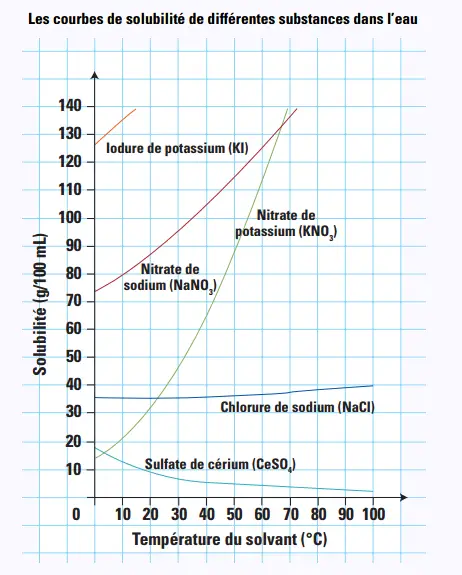
13. Dans le diagramme ci-dessous, quel
est le soluté dont la solubilité ne varie
pratiquement pas avec la température ?
Le chlorure de sodium (NaCl).
14. En général, la solubilité des solides
augmente avec la température. Selon ce
diagramme, quel soluté fait exception à
cette règle?
Le sulfate de cérium (CeSO4).
15. Quelle quantité de nitrate de sodium peuton
dissoudre à 10 °C ?
80 g/100 mL
3. La concentration et la dilution
11. a) Qu’est-ce que la concentration d’une
solution?
La concentration d’une solution
est le rapport entre la quantité de soluté
dissous et la quantité totale de solution.
b) Quelle est l’équation générale
employée pour exprimer la
concentration ?
Concentration = Quantité de soluté/Quantité de solution
12. Exprimez la concentration des solutions
suivantes en grammes par litre (g/L) puis
classez-les en ordre croissant de
concentration.
a) 3,5 g/75 mL
47 g/L
b) 5,6 kg/2 000 L
2,8 g/L
c) 35 g/450 mL
78 g/L
b, a, c.
13. a) Quelle est la concentration en parties
par million (ppm) de 1 g de dioxyde de
carbone contenu dans 1 000 g d’air ?
1000 ppm
b) La teneur en calcium d’une eau de
source est de 35 ppm. Exprimez cette
teneur en grammes par litre (g/L) et en
milligrammes par litre (mg/L).
0,035 g/L et 35 mg/L
14. Calculez la concentration molaire des
solutions formées par les proportions
suivantes.
a) 20 g d’hydroxyde de sodium (NaOH)
dissous dans un volume total de
1000 mL de solution.
0,25 mol/L
b) 250 g de carbonate de calcium
(CaCO3) dissous dans un volume total
de 5 L de solution.
0,5 mol/L
c) 30 g de sulfate de cuivre (CuSO4)
dissous dans un volume total de
2500 mL de solution.
0,075 mol/L
16. Combien de grammes de NaOH dissous y
a-t-il dans un volume total de 100 mL de
solution ayant une concentration en NaOH
de 3 mol/L?
12 g de NaOH
16. Quelles sont les deux façons d’effectuer
une dilution au laboratoire ?
La dilution par
ajout de solvant et la dilution par prélèvement
d’une partie de la solution initiale et ajout de
solvant.
17. On dilue 350 mL d’une solution de nitrate
de potassium (KNO3) ayant une concentration
de 36 g/L en y ajoutant 250 mL
d’eau. Quelle est la concentration de la
solution obtenue?
21 g/L
18. Pour préparer une solution d’acide
chlorhydrique, on utilise une solution de base à
une concentration de 660 g/L d’acide
chlorhydrique. Comment devra-t-on s’y
prendre pour obtenir 1 500 mL de solution
d’une concentration de 36 g/L ?
La solution devra contenir 54 g d’acide
chlorhydrique. On doit donc
prélever 82 mL de solution de base. Elle
ajoutera ensuite un volume suffisant d’eau
distillée pour obtenir un volume de solution
égal à 1 500 mL.
4. La conductibilité électrique et les
1. Comment appelle-t-on les substances qui
permettent au courant électrique de circuler
lorsqu’elles sont dissoutes dans
l’eau ?
Les électrolytes.
2. Quelle sorte de particules sont alors
libérées?
Des ions positifs et négatifs.
5. La dissociation électrolytique
1. Parmi les équations de dissolution suivantes,
lesquelles représentent des dissociations électrolytiques
? Justifiez votre choix.
a. CH3COOH (l) → CH3COO–(aq) + H+(aq)
b. C12H22O11 (s) → C12H22O11 (aq)
c. C2H5OH (l) → C2H5OH (aq)
d. KNO3 (s) → K+(aq) + NO3–(aq)
a et d représentent des dissociations électrolytiques,
car les molécules ont été séparées en ions.
2. Qu’est-ce qui explique qu’un électrolyte
est plus fort qu’un autre ?
Un électrolyte est
plus fort qu’un autre lorsque son taux de dissociation
électrolytique en ions est plus élevé.
3. Qu’ont en commun les acides, les bases et
les sels ?
Les acides, les bases et les sels sont des
électrolytes.
4. Indiquez si les substances suivantes appartiennent
à la catégorie des acides, des bases
ou des sels en observant leur formule chimique.
a. CuSO4 Sel
b. HClO4 Acide
c. KOH Base
d. HNO3 Acide
e. MgCl2 Sel
f. CsOH Base
6.
L’échelle pH
1. Une solution de pH 5,6 est-elle acide,
basique ou neutre ? Justifiez votre réponse.
Il s’agit d’une solution acide, car son pH est
inférieur à 7.
2. Certains savons ont un pH de 10. Combien
de fois l’eau distillée de pH 7 est-elle plus
acide que le savon ?
L’eau distillée est
1000 fois plus acide que le savon, car la
différence de pH est de 3.
|
|