Chimie Organique
Molecules Organiques
et Médicinales
Des planches
BD
Les Aromatiques
© The scientific sentence. 2010
| |
|
Chimie 2:
Chimie organique
Alcools : Méthanol comme carburant
Pile à combustible
La pile à combustible
1. Définition
Une pile à combustible est une pile dans laquelle la
génération d'une tension électrique se fait au moyen d'un
combustible comme l'hydrogène ou l'alcool. Sur une électrode,
l'anode, le combustible réducteur reçu produit une oxydation
couplée à la réduction sur l'autre électrode , la cathode
d'un oxydant, tel que l'oxygène de l'air.
Les piles à combustible sont envisagées pour alimenter
divers appareils nomades, tels que des téléphones ou des
ordinateurs portables.
Alimentées à l'hydrogène, elles sont utilisées pour alimenter
plusieurs prototypes de voitures, de bus électriques,
ainsi que des trains électriques.
2. Principe
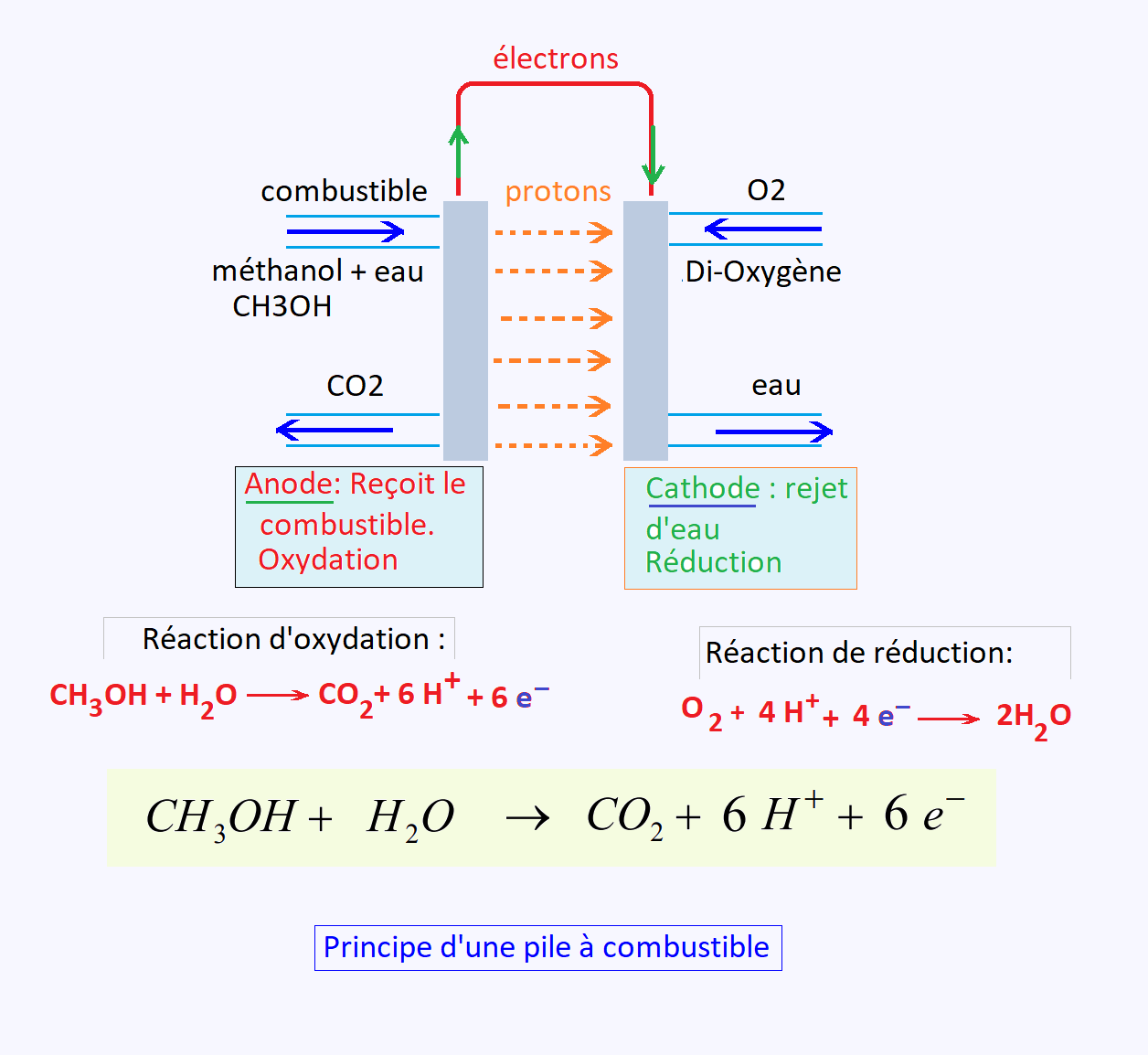
Dans ce système qui est la pile, la réaction chimique
produite est de l' oxydo-réduction . Nous avons alors
les couples corrospondants: H+(aq)/H2(g) et O2(g)/H2O(l), pour
l'hydrogèene ou H+(aq)/CH3OH(l) et O2(g)/H2O(l), pour l'alcool.
• À l'anode, les ions hydrogène, les électrons, et
le di-oxyde de carbone se forment grace au combustible
(hydrogène ou alcool avec eau) selon la la demi-réaction:
H2 → 2H+ + 2e-
ou , avec le méthanol:
CH3OH + H2O → CO2 + 6H+ + 6 e-
Le dihydrogène (H2) se dissocie (oxydation) en ions H+
et en électrons selon : 2H2 = 4H+ + 4e−. Les ions traversent
alors la membrane, mais les électrons, bloqués, sont contraints
d'emprunter un circuit extérieur, ce qui va générer un courant
électrique.
• À la cathode, les ions hydrogène, les électrons, et
le dioxygène (pur ou provenant de l'air) se rencontrent
pour former de l'eau selon la demi-réaction :
4H+ + 4e- + O2 → 2H2 O
L'équation d'oxydo-réduction s'ecrit alors:
CH3OH + H2O → CO2 + 6H+ + 6 e-
Cette réaction produisant un courant électrique, va produire également de la chaleur pouvant être récupérée.
|
|