Chimie Organique
Molecules Organiques
et Médicinales
Des planches
BD
Les Aromatiques
© The scientific sentence. 2010
| |
|
Chimie organique : Les hydrocarbures
Les hybridations sp
La théorie de l'hybridation, ou théorie de la liaison de valence
a été développée au cours des années 1930, notamment par le chimiste
américain Linus PAULING.
C'est une théorie descriptive de la liaison chimique qui
a encore un grand succès en chimie organique, car elle rend assez bien compte de faits expérimentaux, non explicables par la théorie de LEWIS, tels que l' existence de liaisons s et p.
C'est également une théorie qui a ses limites. Ses limites sont dépassées par la théorie des orbitales moléculaires, utilisée, par exemple, dans la molécule de benzène, C6H6.
1. Hybridation: orbitales sp3 et
structure du méthane CH4
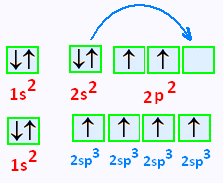 La configuration électronique du carbon est 1s2 , 2s2, 2p2 ,
à l'état fondamental.
La configuration électronique du carbon est 1s2 , 2s2, 2p2 ,
à l'état fondamental.
Une exitation de cet atome amène une promotion d'un électron
de l'orbitale 2s dans l'orbitale 2p vacante, celle
située à droite.
Nous avons donc une combinaison
de l'orbitale s et des 3 orbitales p
, c'est l'hybridation sp3.
On obtient donc 4 orbitales hybrides identiques susceptibles
de former 4 liaisons σ.
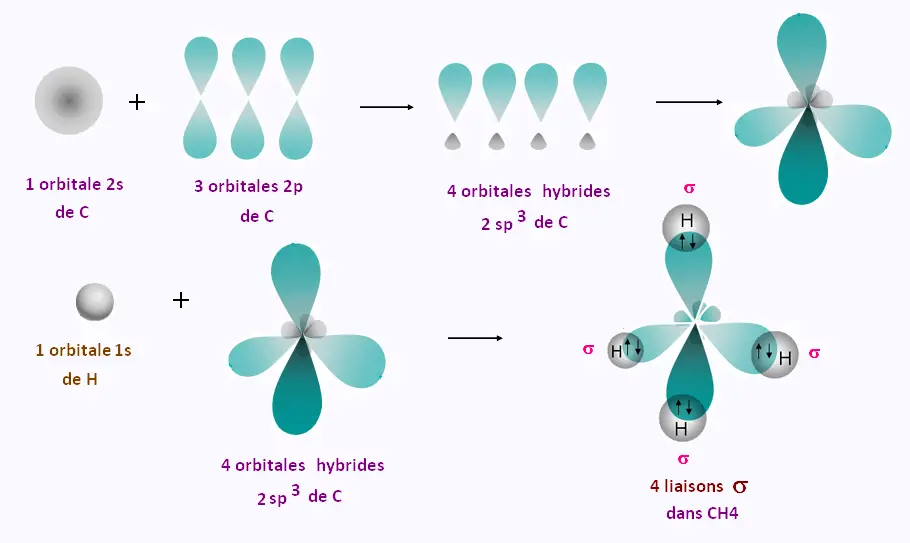
Formation des liaisons dans la molécule CH4
Les 4 orbitales hybrides sp3 ont le même niveau d'énergie. Elles pointent vers les quatres sommets
d'un tetraèdre: La géométrie est tétraédrique.
L'angle entre deux liaisons σ est de 109.5o.
Le recouvrement d'une orbitale atomique sp3 du carbone et d'une orbitale 1S de l'hydrogène s'effectue selon
l'axe joignantles noyaux des deux atomes.
L'orbitale moléculaire formée lors de cette liaison est de type σ
L'orbitale moléculaire formée contient 4 orbitales atomiques
4 x 1s de H et 4 x sp3 de C. Les 4 liaisons C-H
sont des liaisons σ . Nous avons 4 O.A. σ au sommet d'un
tétraèdre. Chaque O.A. contient deux électrons de spines opposés.
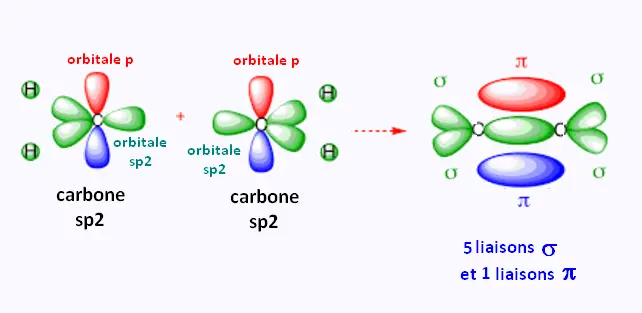
2. Hybridation: orbitales sp2 et
structure de l'éthylène C2H4
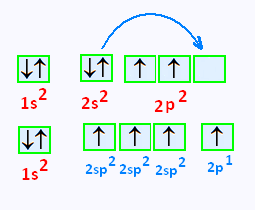
La configuration électronique du carbon est 1s2 , 2s2, 2p2 ,
à l'état fondamental.
Une exitation de cet atome amène une promotion d'un électron
de l'orbitale 2s dans l'orbitale 2p vacante, celle
située à droite.
On isole les 3 premières cases de 2p, on obtient donc
une combinaison
de l'orbitale s et des 2 orbitales p
, c'est l'hybridation sp2.
On obtient donc 3 orbitales hybrides identiques susceptibles
de former 3 liaisons σ et une orbiale p non hybride.
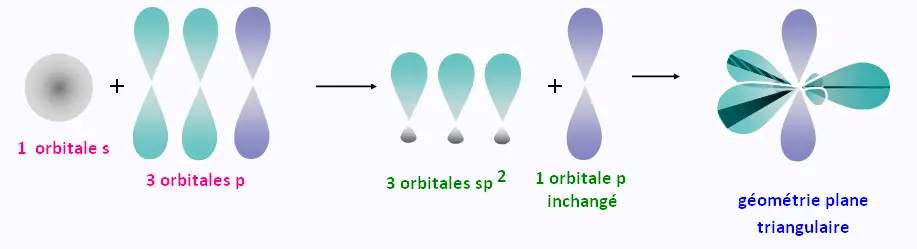
Formation des liaisons dans la molécule C2H4
Les 3 orbitales hybrides sp2 ont le même niveau d'énergie.
Elles sont sur un même plan et font entre elles de 120o.
La géométrie est plane triangulaire .
L'orbitale p d niveau d'énergie supérieur, se trouve dans le plan
perpendiculaire à celui formé par les orbitales
sp2.
Le recouvrement des orbitales atomiques 2p, parallèles non hybrides sp,
des deux atomes de carbone s'effectue latéralement.
L'orbitale moléculaire formée lors de cette liaison est de type π . Ellle contient deux électrons de signee opposés.
L'orbitale moléculaire formée contient 5 orbitales atomiques
4 x 1s de H et 1 x sp2 de C. Les 4 liaisons C-H , et
la liason C-C
sont des liaisons σ . Nous avons 5 O. A. σ
et une 1 O. A. p. Chaque O. A. contient deux électrons de spines opposés.
On note que la première liaison entre deux atomes est de type σ.
tout autre liaison supplémentaire entre ces deux mêmes atomes est de
type π. C'est le cas des doubles ou des triples liaisons.
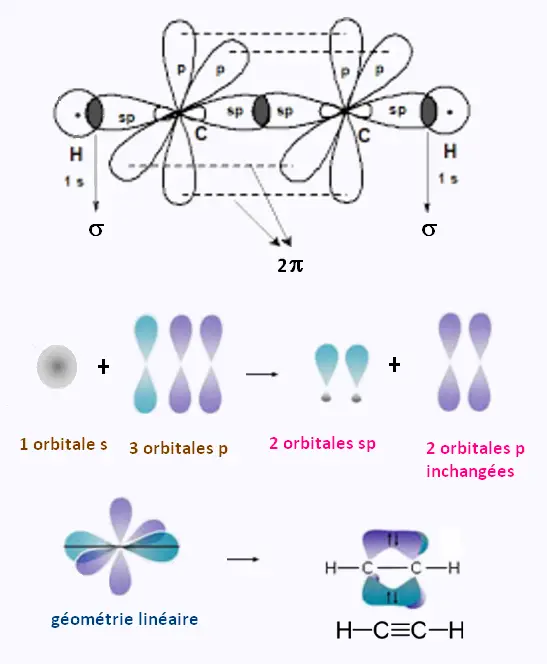
3. Hybridation: orbitales sp et
structure de l'acéthylène C2H2
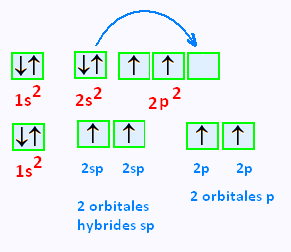
La configuration électronique du carbon est 1s2 , 2s2, 2p2 ,
à l'état fondamental.
Une exitation de cet atome amène une promotion d'un électron
de l'orbitale 2s dans l'orbitale 2p vacante, celle
située à droite.
On isole les 2 premières cases de 2p, on obtient donc
une combinaison
de l'orbitale s et une orbitales p
, c'est l'hybridation sp.
On obtient donc 2 orbitales hybrides identiques susceptibles
de former 2 liaisons σ et deux orbiales p non hybride .
Formation des liaisons dans la molécule C2H2
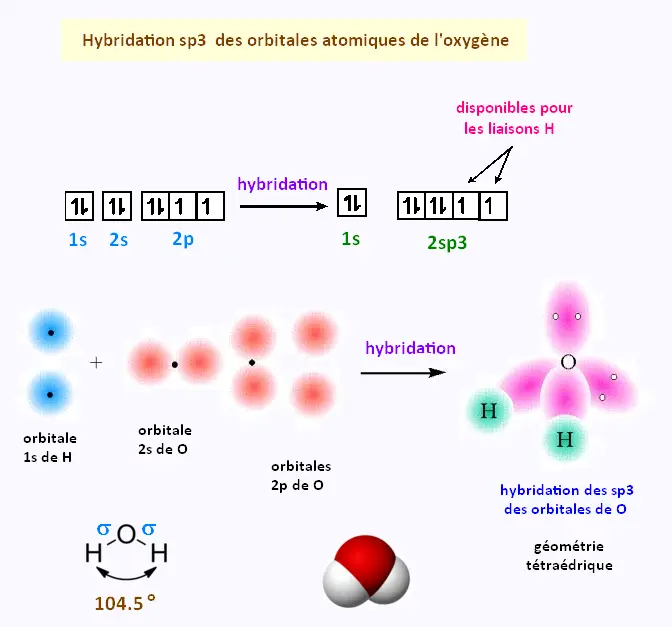
4. Hybridation: orbitales sp3 de H2O
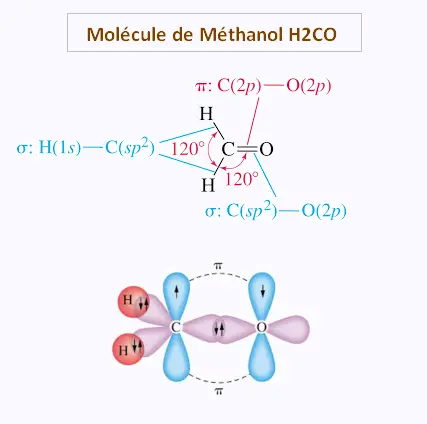
5. Hybridation: orbitales sp2 dans H2CO
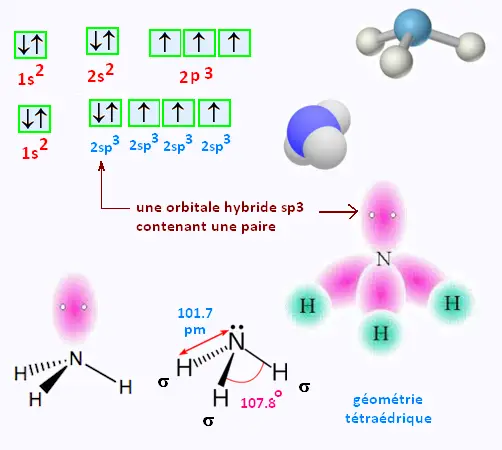
6. Hybridation: orbitales sp3 dans NH3
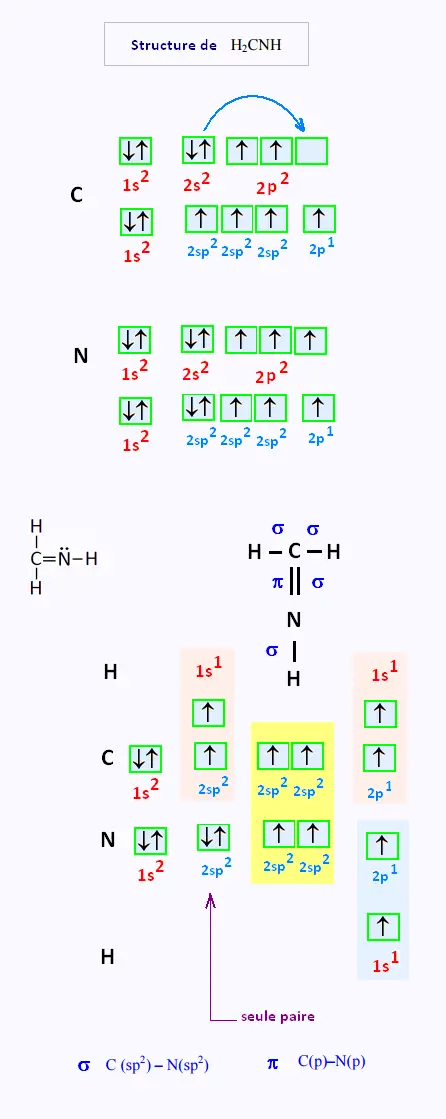
7. Hybridation H2CNH
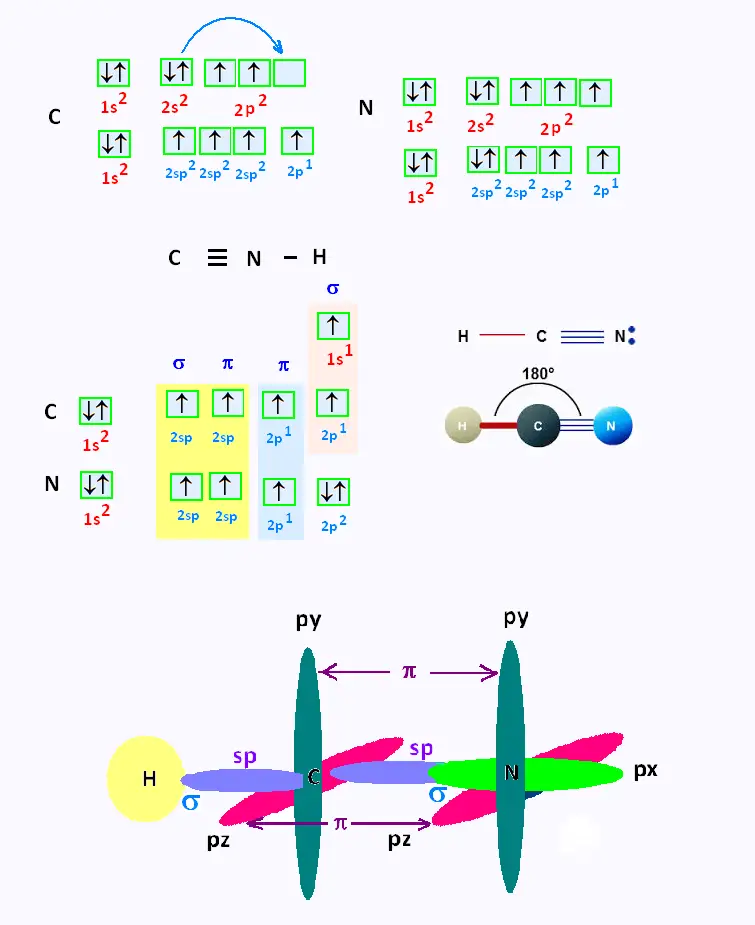
7. Hybridation CHN
8. À propos de Linus Pauling

Linus Carl Pauling , 1901 - 1994, était un chimiste et physicien américain. Il fut l'un des premiers chimistes quantiques, et reçut le prix Nobel de chimie en 1954 pour ses travaux décrivant la nature de la liaison chimique.
Il publie en 1939 un ouvrage, «The Nature of the Chemical Bond», dans lequel il développe le concept d'hybridation des orbitales atomiques.
Il reçut aussi le prix Nobel de la paix en 1962, pour sa campagne contre les essais nucléaires, devenant ainsi l'une des deux seules personnes,
avec Marie Curie, à avoir reçu un prix Nobel dans deux catégories différentes .
9. Hybridation resumé
L'hybridation est la combinaison de 2 ou plus orbitales atomiques
d'un même atome pour former un nouveau ensemble d'orbitales
atomiques hybrides dans le but de faire des liasons.
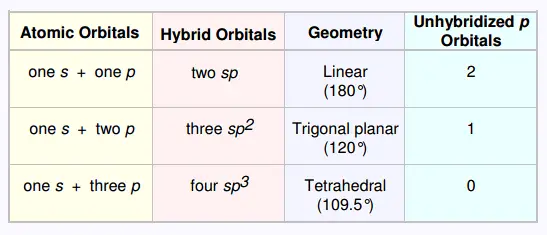
• Une combinaison S + S ou S + P donne une liaison σ
: recouvrement axial.
• Une combinaison P + P donne une liaison π
: recouvrement orbital.
|
|