Chimie Organique
Molecules Organiques
et Médicinales
Des planches
BD
Les Aromatiques
© The scientific sentence. 2010
| |
|
Chimie 2:
Chimie organique
Chimie pharmaceutique
L'aspirine
1. L'aspirine
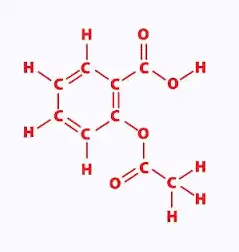
L'aspirine est utilisée depuis plus de cent ans pour soulager la douleur, faire baisser la fièvre et traiter l'inflammation.
En chimie organique, l'aspirine est la molécule d'acide acétylsalicylique (l'AAS).
L'aspirine appartient à plusieurs groupes de médicaments, notamment les analgésiques (les antidouleurs), les antipyrétiques (les réducteurs de la fièvre), les anti-inflammatoires (les réducteurs de l'inflammation), et les inhibiteurs de l'agrégation plaquettaire (les anticoagulants).
L'appellation aspirine vient du nom de marque Aspirin, déposé en 1899 par la société Bayer.
Depuis l'Antiquité, L'écorce de saule est connue pour ses vertus curatives.
Dans le papyrus Ebers, datant des annés 1550 av. JC, on retrouve la mention de décoctions de feuilles de saule que les anciens égyptiens utilisaient.
Le médecin grec Hippocrate (460–377 av. J.-C.) conseillait déjà une préparation à partir de l'écorce du saule blanc pour soulager les douleurs et les fièvres. Les Romains connaissaient aussi ses propriétés.
La décoction est une méthode d'extraction des principes actifs et/ou des arômes d'une préparation généralement végétale par dissolution dans l'eau bouillante.
Formule brute C9H8O4
Masse molaire = 180.157 g/mol.
2. Production de l'aspirine
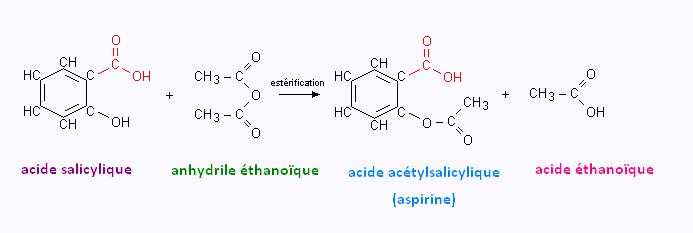
L'acide acétylsalicylique est obtenu par acétylation de l'acide salicylique. Son nom vient du latin salix « saule ». Cet acide ayant été isolé pour la première fois dans l'écorce de cet arbre. Le saule (Salix) est un arbuste de la famille des Salicacées (Salicaceae).
3. Groupes fonctionnels dans l'aspirine
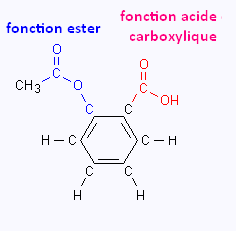
4. À propos de l'aspirine
L'aspirine a plus de 100 ans. C'est en 1899 que le laboratoire Bayer l'a lancée sur
le marché. Mais déjà avant l'antiquité, les grecs en utilisaient sans le savoir :
ils réalisaient des décoctions de feuille de saule, réputées pour leurs vertus
contre la fièvre et les douleurs.
Or le principal ingrédient de l'aspirine est l'acide acétyl-salicylique, que
l'on trouve à l'état naturel dans certaines plantes, notamment l'écorce de saule.
Aujourd'hui, l'aspirine est synthétisée chimiquement à partir de phénol C6H5OH.
L'aspirine est le medicament le plus consommé au monde : 35 000 tonnes
sont produites chaque année, soit 100 milliards de comprimés.
Intégrée à de nombreuses autres préparations, elle est contenu dans des
centaines médicaments.
L'aspirine est absorbée par les parois intestinales. À cet effet, la forme
effervescente est bien approprié.
Face à une agression comme un virus ou brûlure l'organisme secrète de la
prostaglandine , une substance qui augmente la mobilité des cellules chargées
de nous protéger comme les globules blancs ou les anticorps. Mais cette substance
abaisse le seuil de stimulation des récepteurs de la douleur et provoque des
rougeurs ou la fièvre. Ici, l'aspirine vient réduire sa production et semobilise
comme un anti-inflammatoire et analgésique.
L'effet anticoagulant de l'aspirine prolonge le temps de saignement. Elle est donc
formellement déconseillée aux hémophiles.
On a jamais de l'aspirine pure ! On y ajoute des excipients divers comme lev
bicarbonate de sodium , pour améliorer son goût, sa solubilitév.
L'aspirine est aussi souvent vitaminée, on ajoute alors de l'acide ascorbique (vitamine C).
L'aspirine réduirait les risques de cancer du colon, diminuerait la croissance
des tumeurs cancéreuses.
|
|