Chimie 2
Réactions chimiques
Vitesse de réaction
1. L'énergie d'activation
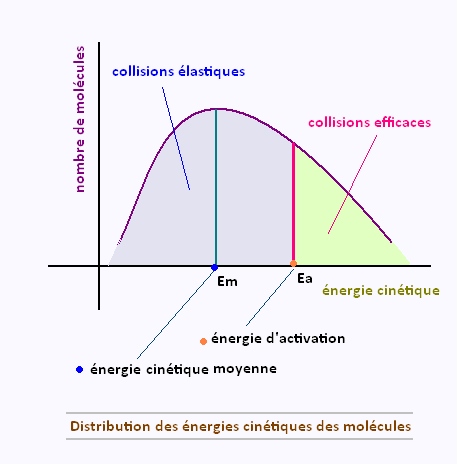
Certaines réactions chimiques se produit tout naturellement.
Elles ces dites spontanées. D’autres réactions, par contre, ne se produiront qu'avec un apport externe d’énergie. Ces réactions possèdent une barrière d’énergie, appelée énergie d'activation, qui doit être franchie pour amorcer la transformation des réactifs en produits.
Une réaction chimique a lieu lorsque les liens sont brisés entre les atomes des molécules de réactifs pour former de nouvelles molécules qu’on appelle produits. Pour que ce processus puisse s’effectuer, les molécules de réactifs
doivent entrer en collision. Toutes les collisions ne conduisent pas à la formation de produits.
Seules les collisions efficaces donnent lieu à une réaction entre les molécules de réactifs.
Pour être efficace, les réactifs doivent entrer en collision avec une vitesse suffisante pour créer un complexe activé et par la suite former les produits.
On appelle énergie d'actication l’énergie minimale que doivent avoir les molécules pour produire une collision efficace. Si les
molécules ne possèdent pas assez d’énergie cinétique, elles subissent une collision élastique, c’est-à-dire qu’elles rebondissent sans avoir formé de produits.
En général, seule une petite partie des molécules produisent des collisions efficaces, la majorité des collisions étant élastiques.
La vitesse d’une réaction est directement proportionnelle au nombre de collisions efficaces: plus il y a de collisions efficaces entre les molécules de réactifs, plus la réaction sera rapide.
La proportion des collisions efficaces est plus
grande quand la barrière d’énergie est faible.Elle est plus
petite quand la barrière d’énergie est grande.
2. Effet de l’énergie d’activation sur
la vitesse d’une réaction
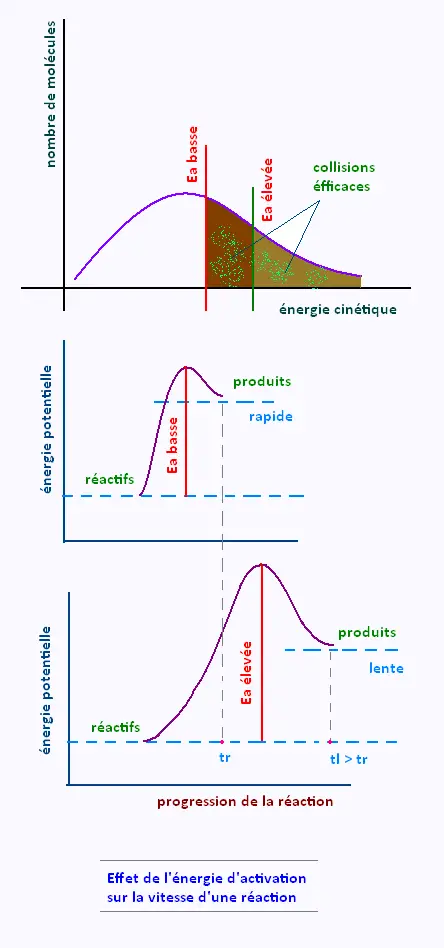
Une réaction dont l’énergie d’activation est basse donnera lieu à un grand nombre de collisions efficaces , elle sera alors plus rapide qu’une réaction dont l’énergie d’activation est élevée qui donne lieu à un faible nombre de collisions efficaces
|