Chimie: Les piles électrochimiques
L'énergie chimique
1. Transformation chimique: solution de sulfate de cuivre et poudre de zinc
Le but est d'étudier la transformation chimique qui se produit
lorsque de la poudre de zinc métallique est en contact avec une solution
de sulfate de cuivre.
1.1. Expérience:
À 20oC, on place de la poudre de zinc dans un tube à
essais, on ajoute quelques millilitres de sulfate de cuivre, puis
on agite et on observe le résultat.
• En touchant le tube à essai on peut se rendre compte que celui-ci
est devenu chaud.
• Une mesure de température à l'aide d'un thermomètre
permet de confirmer que la température de la solution est nettement plus
élevée après le mélange qu'avant.
• La solution de sulfate de cuivre initialement bleue devient
quasiment incolore.
• La poudre de zinc change de couleur: elle prend par endroit une couleur
orangée.
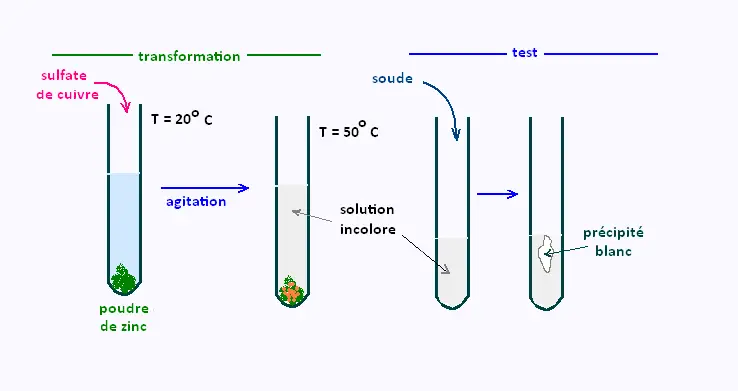
1.2. Test de reconnaissance sur la solution obtenue:
On effectue un test complémentaire de reconnaissance d'ion sur la
solution obtenue.
On ajoute de la soude et on obtient un précipité qui n'est pas bleu mais blanc.
Ce test permet de déduire que les ions cuivre, dans la solution de sulafte de cuivre, ont bien disparus de la solution aqueuse et qu'ils ont laissé la place aux ions zinc qui forment un précipité blanc avec la soude.
Il se produit bien une transformation chimique car des composés chimiques apparaissent et d'autres apparaissent.
La disparition de la couleur bleu et l'absence de précipité bleu lors du test indique que les ions cuivres disparaissent tandis que du cuivre métallique se forme sur la poudre de zinc restante.
Le test complémentaire indique que des ions zinc sont apparus et ceux-ci ne peuvent se former qu'à partir des atomes de la poudre de zinc métallique.
Les ions sulfate ne subissent aucune modification particulière et restent en solution après la transformation chimique où ils forment avec les ions zinc une solution de sulfate de zinc.
Ces transformations peuvent être traduits par la réaction chimique suivante:
Zinc + sulfate de cuivre → cuivre + sulfate de zinc
Cette transformation chimique s'accompagne également d'un dégagement de chaleur.
On dit qu'elle est éxothermique.
L'énergie chimique qui était présente dans les réactifs est donc en partie libérée, sous forme d'énergie thermique.
2. Les piles électrochimiques
La pile au sulfate de cuivre
1. La composition de la pile au sulfate de cuivre
La pile au sulfate de cuivre est un exemple de pile électrochimique.
Elle est constituée d'une plaque de cuivre et d'une plaque de zinc qui jouent le rôle d'électrodes. Ces électrodes correspondent aussi aux deux bornes de la pile.
Ces deux électrodes baignent dans une solution ionique de
sulfate de cuivre: on dit que cette solution est un électrolyte.
Un électrolyte est un milieu rendu conducteur par les ions qu'il contient.
2. Tension de la pile au sulfate de cuivre
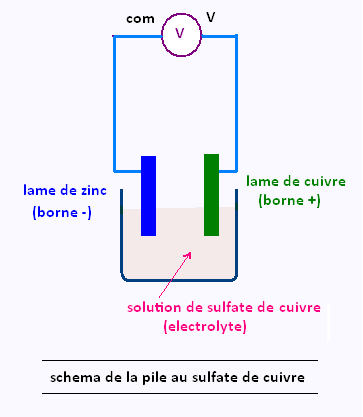
En reliant un voltmètre aux bornes de la pile on peut mesurer une tension de l'ordre de 1 V.
Cette tension n'est positive que lorsque la borne com du multimètre est reliée au zinc et la borne de tension est reliée au cuivre.
D'après les règles de branchement d'un voltmètre, on en déduit que:
• Le zinc correspond à la borne négative.
• Le cuivre correspond à la borne positive
3. Les piles électrochimique: L'énergie chimique
et l'énergie électrique
La pile au sulafate de cuivre est capable de fournir du courant
électrique et de faire fonctionner des dipôles comme des DEL.
Au lieu de transformer leur énergie chimique en chaleur le sulfate de cuivre et le zinc la transforme en grand partie en énergie électrique.
Dans une pile électrochimique l'énergie chimique est convertie en énergie électrique.
Lorsque l'un des réactifs a été entièrement consommé la transformation chimique ne peut plus se faire et la pile ne peut plus produire d'énergie électrique. On dit qu'elle est déchargée.
La plupart des piles électrochimiques sont comparables à celle au sulfate de
cuivre:On y trouve toujours deux métaux différents ainsi qu'un électrolyte.
|