Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Traitement d'une eau
1. Tendence d'une eau
|
Une eau est soit entartrante soit corrosive. L'indice de langelire
permet de spécifier cette tentence. Cet indice s'ecrit:
I = pH - pHs
pH est mesuré et pHs est déterminé graphiquement.
Si I est positif → l'esu est entartrante. Si I est négatif → l'eau est corrosive.
Si I est nulle, l'eau n'est pas entartrante et n'est pas corrosive.
En effet, l’équilibre relatif au carbonate de calcium appelé l'équilibre calco-carbonique:
Ca2+(aq) + 2 HCO3- (aq) ↔ CaCO3(s) + CO2 (g) + H2O (l)
peut se déplacer à gauche, favorisant les réactions de dissolution
du carbonate de calcium CaCO3 (dit calcaire) lorsque l’eau
est sous saturée en CaCO3. Dans ce cas l'eau est douce et peu alcaline; elle
est dite agressive ou corrosive.
Cet équilibre peut aussi se déplacer à droite favorisant la précipitation du carbonate
de calcium. Ici, l'eau est saturée en CaCO3, dure et alcaline, et est
appelé entartrante (le tartre protège les coduite d'eau).
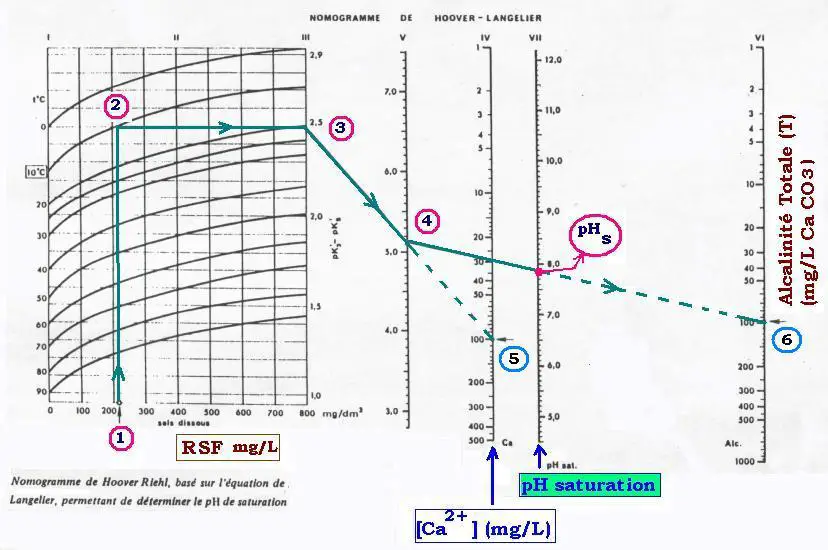
La méthode graphique permettant de déterminer la valeur du pHs de saturation
utilise le nomogramme de Hoover Riehl :
La salinité totale (RSF: Résidu Sec Filtrable) (1) et la température (2)
définissent le point (3). Le point pivot (4) est défini
en joignant le point (3) au point représentant la dureté calcique (5).
Le pHs est ensuite défini par la droite joignant (4) à l’alcalinité (6).
Exemple:
RSF = 210 mg/L à 10 oC, avec une une dureté calcique de 100 mg/L
et une alcalinité totale de 100 mg/L CaCO3 , donne un
pHs de 7.8.
2. Clarification
Clarifier une eau, c'est éliminer ses MES et ses MC. Les MES (Matières (ou Masses)
En Suspension) sont des particules de taille 1 mm - 1 µm, décantables, visibles à
l'oeil nu et retenues par les filtres. Les MC (Matières Colloidales) sont des particules de
taille 1 µm - 1 nm non décantables, visibles au microscope et non retenues par les
filtres.
En d'autres termes, la clarification consiste en la décantation accélérée par des additifs
chimiques. Elle comprend trois étapes: la coagulation, la floculation, et la
décantation.
* La coagulation consiste en neutraliser les particules colloidales de charges négatives et
les ramasser en des petits blocs appelés microflocs. On utilise pour ce procédé des additifs
comme le sulfate d'alluminium Al2(SO4)3 appelé Alun
et le sulfate ferrique Fe2(SO4)3.
* La floculation consiste à rendre les microflocs des macroflocs décantables, sorte de
polymères comme le polyacrylamide [CH2 CH CO NH2]n.
* la décantation utilise la gravité pour faire précipiter les particules.
3. Adoucissement à la chaux
Adoucir une eau à la chaux, c'est reduire ses ions Ca2+, Mg2+et HCO3-,
c'est à dire réduire sa dureté totale en reduisant son alcalinité ou sa dureté temporaire.
Le principe c'est d'ajouter l'hydroxyde de calcium, appelé chaux à l'eau qui
réagiront avec le bicarbonate de calcium et le bicarbonate de magnésium:
Ca(HCO3)2 (aq) + Ca(OH)2 → 2CaCO3 (s) + 2H2O
Mg(HCO3)2 (aq) + 2 Ca(OH)2 → 2CaCO3 (s) + Mg(OH)2 (s) + 2H2O
L'expérience montre que:
* La quantité de chaux nécessaire est fonction de l'alcalinité totale et de la dureté magnésienne:
Ca(OH)2 (mg/L) = 0.74 [Alc T (mg/L CaCO3) + Mg2+ (mg/L CaCO3)]
* Son controle de qualité est fonction de l'alcalinité P et T:
2P - T = 10 (mg/L CaCO3)
Après une clarification (coagulation, floculation et décantation) et un
traitement à la chaux on peut filtrer l'eau dans le but d'éliminer
les MES (masses en suspention) résiduelles; en utilisant un sable de silice ou une anthracide.
4. Déminéralisation d'une eau
Il existe un autre adoucissement, c'est l'adoucissement sur résine (zéolite), qui
consiste à réduire d'avantage la dureté d'une eau jusqu'à 0.5 ppm CaCO3. On passe
l'eau à travers une résine cationique de type ZNa2 qui élimine tous les cations,
et génère des ions Na+ (qui ne sont pas entartrants) en présence des anions:
Ca2+, Mg2+, HCO3-, SO42-, Cl- → [ZNa2] → Na+, HCO3-, SO42-, Cl-
La résine ZNa2 agi de la façon suivante:
Ca2+ + ZNa2 → ZCa + 2 Na+
La déminéralisation d'une eau se fait en deux étapes. La faire
passer à travers une résine cationique pour éliminer tous
cations (Ca2+ Mg2+) et ensuite à travers une résine anionique pour éliminer tous lea anions
(HCO3-, SO42 - et Cl -).
Une résine cationique du type ZH2 élimine tous les cations sauf les H+, une résine
anionique du type Z(OH)2 élimine tous les anions sauf les (OH)-.
Une combinaison des deux élimine donc tous les ions en formant de l'eau:
ZH2 + Ca2+ → ZCa + 2H+
Z(OH)2 + 2 Cl- → ZCl2 + 2(OH)-
2H+ + 2(OH)- → H2O
Ce méchanisme est appelé échange ionique. Une eau ainsi déminéralisée est
faiblement conductrice (κ: de 5 à 20 µS/cm) est pratiquement neutre (pH de 7 à 9).
Une résine cationique possède un groupement fonctionnel SO3-, tandis qu'une
résine anionique possède un groupement fonctionnel amine NR3+.
5. Autres traitements d'une eau
Une chloration d'eau consiste à ajouter à l'eau du chlore, de
l'hpochlorite de sodium NaCLO ou de calcium Ca(ClO)2.
Un conditionnement consiste en des ajouts d'agents chimiques dans le but de contrer
les effets résiduels sur l'entartrage et la corrosion.
Pour contrer l'entartrage, on ajoute
du phospahte de sodium Na3PO4. Une fois dissous, les ions PO43-
se combinent avec les cations Ca2+ et Mg2+ pour former un précipité boueux éliminable
par des purges.
En ce qui est de la corrosion, on élimine l'oxygène et le dioxyde de carbone. On utilise deux additifs pour l'oxygène:
le sulfate de sodium Na2SO3 et l'hydrazyne NH2-NH2 qui réagissent respectivement de la façon suivante:
Na2SO3 + (1/2)O2 → Na2SO4
NH2-NH2 + (1/2)O2 → N2 + 2H2O
Pour le dioxyde de carbone, on ajoute une amoniaque NH4OH ou une amine filmante. La
première neutralise H2CO3, la seconde forme un film protecteur
sur l'interface métal-eau.
Le dégazage consiste ne chauffer l'eau pour permettre au gaz de s'évaporer puisqu'il
moins soluble à haute température.
|