Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Bilan thermique d'une colonne de distillation
1. Définitions et formules:
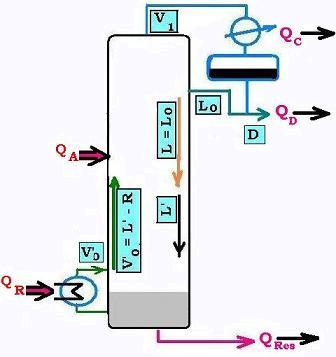
Il s'agit de faire le bilan d'energie au sein d'une colonne de distillation, recevant un mélange. Dans ce chapitre, nous allons étudier le cas d'un mélange binaire. Le débit de chaleur est exprimé en kiloCalories par heure ( kcal/h).
Nous avons cinq débits thermiques à considérer:
• Le débit de chaleur entrant apporté par l'alimentation (ou la charge) QA. Qualitativement, ce
débit est composé de vapeur et de liquide; quantativement, d'un pourcentage molaire des constituants (exemple: propane et butane).
La fraction molaire à considérer est le z% du léger (le plus volatil).
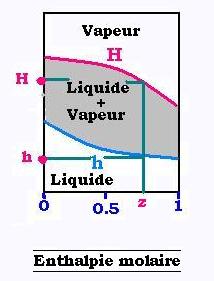
Ce débit de chaleur QA se calcule en utilisant le diagramme enthalpique à une pression fixée du mélange considéré.
Pour chaque fraction molaire z% du léger, on lit son enthalpie molaire h liquide: de bulle ou son son enthalpie molaire H vapeur: de roséecorrespondante, qui s'expriment en kcal/kmol. Ainsi, le débit de chaleur prend l'expression:
QA = Enthaplie molaire de la charge A x Débit molaire de la charge A (liquide ou vapeure)
Charge liquide : QA = h DA
Charge Vapeur : QA = H DA
• Le débit de chaleur du condenseur, qui doit condenser la valeur de tête
de dédit molaire le débit molaire V1. Il le transforme de vapeur en liquide, donc l'enthalpie molaire correspondante passera de H à h. Ainsi, le débit de chaleur prendra la forme:
QC = Λ V1 = (H - h) V1
On sait que V1 = D + Lo, où D est le débit molaire du distillat et Lo le débit molaire du reflux externe. Il vient:
QC = Λ V1 = (H - h) V1 = (H - h) (D + Lo)
On sait aussi que le taux de reflux rf est :
rf = Lo/D
Donc:
QC = (H - h) D(1 + rf)
• Le débit de chaleur du distillat sortant en tête est égal au produit de son débit molaire et de son enthalpie molaire correspondante qui h (puisque c'est un liquide, h de rosée correspond à celle du liquide de charge entrant). Ainsi:
QD = h Ddistillat = h D
• Le débit de chaleur du résidu sortant en fond de colonne est égal au produit de son débit molaire et de son enthalpie molaire correspondante qui h (puisque c'est un liquide, h de rosée correspond à celle du liquide de charge entrant ou amlimentation A). Ainsi:
QRes = h RRes
On sait que le le taux de rebouillage rb s'ecrit par définition:
rb = Vo/Rres
Où Vo est le débit molaire de vapeur généré et sortant du rebouilleur, et RRes
est le débit molaire du résidu sortant contenant les constituants les plus lourds.
Donc:
QRes = h RRes = h Vo/rb
On sait aussi que le débit de vapeur remontant le zone d'épuisement V'o est éagal à celui
généré par le rebouilleur Vo. Ce que perd Vo par condensation de vapeur au fond de colonne due
au liquide descendant à travers la zone d'épuisement de débit L', le gagne par évaporation de même quantité de
le liquide de L'. Par conséquent, L' = Vo + Rres
rb = Vo/Rres = Vo/(L' - Vo) = Vo/(L' - rb RRes)
Où Vo est le débit molaire de vapeur généré et sortant du rebouilleur, RRes
est le débit molaire du résidu sortant contenant les constituants les plus lourds, et L' le débit
liquide desendant à travers la zone d'épuisement.
Donc:
QRes = h RRes = h Vo/rb = h (L' - Vo)
• Le débit de chaleur entrant dans la colonne sous forme de vapeur à partir du rebouilleur prend l'expression thermodynamique à pression constante suivante:
QR mcpΔT
Où m est la masse du liquide, de chaleur massique cp, pompé du fond de la colonne pour le surchauffer d'une température à une autre plus grande; soit une différence de température ΔT.
QR = m cp ΔT
Le bilan enérgétique s'ecrit:
QA + QR = QC + QD + QRes
II. Exemples relatifs à un dépropaniseur
Un dépropaniseur est une colonne de distillation du mélange
binaire C3 = C3H8
et C4 = C4C10.
Masse molaire du C3 = M3= 3 x 12 + 1 x 8 = 44 g/mol
Masse molaire du C4 = M4 = 4 x 12 + 1 x 10 = 58 g/mol
On pose:
Nombre de moles de C3 = n3
Nombre de moles de C4 = n4
Nombre de moles de totales = n = n3 + n4
Masse de C3 = m3
Masse de C4 = m4
Masse totale m = m3 + m4
m = m3 + m4 = n3 M3 + n4 M4 = n3 M3 + (n - n3) M4 = n3(M3 - M4) + n M4
m/n = (n3/N)(M3 - M4) + M4
n3/n = y = pureté C3
la masse molaire du mélange M = est donc:
M = m/n = y(M3 - M4) + M4
M = m/n = y(44 - 58) + 58 = 58 - 14y (g/mol)
M = m/n = (58 - 14y)/1000 (tonne/kmole)
Pour un dépropaniseur:
1 kmole ≡ (58 - 14y)/1000 tonnes
y = pureté en C3
On utilise les unités suivantes:
La thermie (th) : 1 th = 1000 kcal = 1 Mcal (Mégacalorie)
Le British Thermal Units (BTU): 1 kcal = 3.9685 BTU
y = 98% → m/n = y(44 - 58) + 58 = 58 - 13.72 = 44.28 (g/mol)
44. 28 g → 1 mole; donc:
1 tonne/ 1kmole = 1000 /44.28 ou kmole/tonne = 0.04428
Exemple 1
rf = 3.75, Lo = 152.7 t/j et Λ = 66.0 th/t
QC = ΛV1 = Λ (Lo + D) = Λ Lo [1 + D/Lo] =
Λ Lo [ 1 + (1/rf)]
66 x 152.7 x 4.75 /3.75 = 12765.72 (th/t) x (t/j) = 12765.72 th/j (thermies/jour)
Exemple 2
Si Λ = 66.0 th/t, rf = 4.10, D = 175.0 kmol/h, et que
la pureté du plus léger C3 est de 98.0% molaire.
Nous avons:
QC = ΛV1 = Λ (Lo + D) = Λ D [1 + rf]
66 x 175.0 x 5.10 = 58,905 (th/t) x (kmol/h)
(th/t) x (kmol/h) = (1000 kcal/t) x (kmol/h) = (1000 kcal/h) x (kmol/t) = (1000 kcal/h) x (0.04428) = 44.28 kcal/h
m/n = y(44 - 58) + 58 = 58 - 14y g/molm/n = y(44 - 58) + 58 = 58 - 14y
Généralement,
Pour un mélange de masse molaire M:
(th/t) x (kmol/h) = (1000 kcal/t) x (kmol/h) = (1000 kcal/h) x (kmol/t) =
(1000 kcal/h) x (M/1000 ) = M (en kcal/h)
Il vient donc:
QC = 58,905 (th/t) x (kmol/h) = 58,905 x 44.28 kcal/h = 2608313.4
Exemple 3
h = 325 kcal/kmol, rf = 1.9, Lo = 38.0 kmol/h.
On calcule le débit thermique au distillat. Nous avons:
QD = h D = h x L0/rf = 325 x 38.0/1.9 = 6500 kcal/h
1 kcal = 3.9685 BTU → QLD = 6500 x 3.9685 = 25795.25 BTU/h
Exemple 4
Pour un condeneur: QC = Λ V1 = (H - h)V1 = (H - h)(Lo + D) =
(H - h) D (rf + 1)
QC = (H - h) D (rf + 1) → H = [QC /D(1 + rf) ] + h
Exemple: H = 436,000/(45 x 3.10) + 300 = 3425.45 kcal/mol
Exemple 5
Pour un condeneur: QC = Λ V1 = (H - h)V1
= (H - h)(Lo + D) = (H - h) Lo [(1/rf) + 1] → (1/rf) + 1 = QC/(H - h) Lo
→ 1/rf = QC/(H - h) Lo - 1 .
Donc:
rf = 1/[QC/(H - h) Lo - 1]
M = m/n = y(44 - 58) + 58 = 0.99(44 - 58) + 58 = 58 - 13.86 = 44.14 (g/mol)
rf = 1/ 44.14 x [16400/(3450 - 300)x 180 - 1] = 1/[1.2767 - 1] = 3.614
Exemple 6
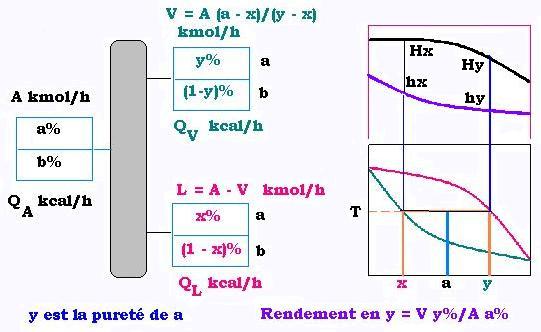
Le mélange binaire a% + b% de débit molaire = A kmoles/h et de
débit thermique = QA kcal/h rentre dans une colonne à distiller; a étant le plus léger.
À la température T, dans la lentille d'équilibre, le a% se décompose en x% liquide et y% vapeur dans le mélange.
Nous avons: A = V + L où L est le liquide et V la vapeur dans le mélange binaire. V et se calcule à l'aide de la règle du levier:
V = A(a - x)/(y-x), donc:
L = A - V
dans le diagramme enthalpique x% (liquide) correspond à h (liquide) et y (vapeur) correspond à H (vapeur).
V et L sont respectivement les débits de vapeur et le liquide en tête et au fond de la colonne,
donc distillat D et résidu Res (V a été juste condensé).
Nous avons:
QD = hy D , où hy est l'enthalpie molaire liquide correspondant à y.
QRes = hx Res , où hx est l'enthalpie molaire liquide correspondant à x.
QC = (Hy - hy)V1 = (Hy - hy)(Lo + D)
À l'entrée de la colonne, la charge A est partiellement vaporisé: a% est de y1 vapeur et de x1 liquide, donc :
y1 → Hy1 et x1 → hx1 .
le débit vapeur est VA = A (a - x1)(y1 - x1) et LA = A - VA.
Donc: QA = QVA + QLA = Hy1 V + hx1 L.
Il reste QR qui vaur:
QR = QC + QD + Qres - QA
Application:
A = 175 kmol/h, a = 57.1%, D = 100, DRes = 175 - 100 = 75 kmoles/h.
y = 97%, x = 4.0%.
y1 = 48%, x1 = 68.5%.
rf = 3.20
Nous avons donc:
QD = h(y = 97% liquide) D = 400 x 100 = 40,000 kcal/mole
QRes = h(x = 4.0% liquide)DRes = 2250 x 75 = 168750 kcal/h
QC = [(H (y = 97% vapeur) - h(y = 97% liquide)(Lo + D)
rf = Lo/D, donc:
QC= [3500 - 400]D(rf + 1) = (3500 - 400) x 100 x 4.20 = 1302000 kcal/h
VA = 175 x (0.571 - 0.48)/(0.685 - 0.48)= 77.7 kmole/h
LA = 175 - VA = 97.3 kmol/h
QVA = H(y1 = 68.5% vapeur) x 77.7 = 4300 x 77.7 = 334110 kcal/mole
QLA = h(x1 = 48.0% liquide)x 97.3 = 1150 x 97.3 = 111895 kcal/h
Donc:
QA = QLA + QVA = 446005 kcal/h
QR = QC + QD + Qres - QA = 1466150 kcal/h
|